研究发现一种新颖的神经类组织可在脊髓损伤处重建中继脑源性神经信息的神经通路
来源:中山大学 2024-10-20 12:39
该研究阐明全横断脊髓损伤后,LINGO-1的高表达阻断了TrkC (NT-3受体) 二聚体的形成,导致神经元死亡。
中山大学曾园山团队联合广东省人民医院李戈团队在国际期刋Chemical Engineering Journal上在线发表了题为:The LINGO-1-deficient neural stem cell-derived neural tissueoid showed enhanced retention and neuronal relay in the transected spinal cord的研究成果。该研究表明,敲低跨膜蛋白LINGO-1可以减少移植的神经类组织细胞死亡,保存了更多的神经元,它们在脊髓损伤/移植处重建了中继脑源性神经信息的节段性神经通路 (附图)。
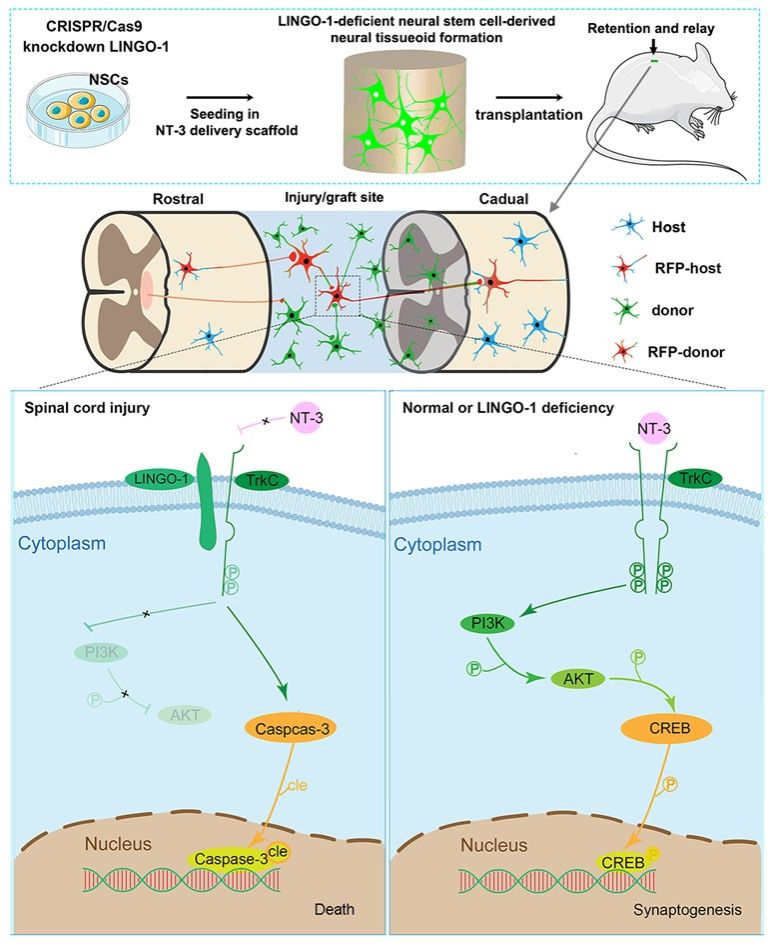
附图: LINGO-1缺失型神经类组织移植在全横断脊髓损伤/移植处重建了中继脑源性神经信息的节段性神经通路
全横断脊髓损伤后,LINGO-1通过增加cle-Capase-3导致细胞死亡,并与TrkC相互作用,降低PI3K/AKT/CREB轴的磷酸化,引起突触降解。CRISPR-Cas9介导的LINGO-1缺失将促进供体神经元TrkC二聚体的形成和磷酸化,并激活下游经典的突触形成信号通路。
严重的脊髓损伤会导致节段性脊髓组织损毁,中断了传导上、下行神经信息的神经通路,造成患者运动和感觉障碍,致残率极高,至今还没有有效的治疗方案。因此,脊髓损伤修复仍是当今世界性医学难题。随着组织工程类组织制造技术的不断创新,基于干细胞策略诱导制造的具有突触传递功能的神经类组织 (neural tissueoid),能够有效替换损毁的脊髓组织,为全横断脊髓损伤/移植处重建节段性神经通路提供了可能。
然而,严重的脊髓损伤微环境不利于移植的神经类组织长期存活。因此,寻找促进神经类组织在脊髓损伤/移植处长期存活的关键靶点至关重要,这对推动脊髓损伤修复的基础和临床转化研究具有重要的科学意义。
研究团队通过对受损伤脊髓组织细胞和移植神经类组织细胞的观察,发现脊髓损伤后跨膜蛋白LINGO-1显著上调,这一过程伴随着程序性细胞死亡相关分子和跨膜蛋白TrkC基因Ntrk3(NT-3受体基因)的高表达。进一步的单细胞数据分析结果显示,LINGO-1与TrkC共定位于神经元等细胞中,在脊髓损伤后具有相似的表达谱。它们能够通过非共价键相互结合,激活下游Caspase-3蛋白,这一过程伴随着抑制TrkC磷酸化介导的经典PI3K/AKT突触形成信号通路,表明LINGO-1可能是引起细胞死亡和抑制突触形成的关键靶点。
进一步借助CRISPR-Cas9技术,建立LINGO-1敲低的神经干细胞并将其种植于NT-3缓释三维支架中,在体外诱导自组织形成LINGO-1缺失型神经类组织。该神经类组织具有突触和髓鞘形成潜能,保留了神经组织的多样性和神经元的功能活性,具有抗凋亡能力。
然后,研究团队将LINGO-1缺失型神经类组织移植到全横断脊髓损伤处,两个月后,观察到大鼠皮质运动诱发电位和瘫痪后肢运动功能有明显改善。此外,该神经类组织细胞可以更多地存活并驻留于损伤/移植处。
同时,在损伤/移植处观察到移植细胞周围富集神经营养素-3 (NT-3),显示出持续的神经保护和突触形成信号激活,促进更多的移植神经元与下行的5-HT阳性神经纤维及上行的CGRP阳性神经纤维建立功能性连接。最后,研究团队通过PRV跨多突触逆行神经通路示踪揭示,这种新颖的LINGO-1缺失型神经类组织的神经元可以将脑源性信息中继至损伤/移植处尾侧端脊髓固有神经元,起到了神经元中继器 (neuronal relayer) 的作用 [注:神经元中继器 (又称内、外源性神经元) 是脊髓损伤/移植处的结构和功能单位,主要由神经干细胞分化而来。这类神经元接收和整合多个输入电信号后通过其突触前膜电压门控型离子通道的开启,将生物电信号传递给突触后神经元并调整其活动状态。引自:解剖学杂志,2024, 47:86]。
综上所述,该研究阐明全横断脊髓损伤后,LINGO-1的高表达阻断了TrkC (NT-3受体) 二聚体的形成,导致神经元死亡。CRISPR-Cas9介导的供体神经元中的LINGO-1缺失促进了其TrkC二聚体的形成和磷酸化,从而激活了经典的突触形成信号通路。NT-3递送支架中的LINGO-1缺失型神经类组织增强了供体神经元的存活、节段性神经通路的重建及其脑源性神经信息的中继。
曾园山教授和李戈研究员为共同通讯作者。李戈研究员、黄莉钧博士及张宝博士后为该研究论文的共同第一作者,该研究受国家自然科学基金项目和广东省自然科学基金项目等项目资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


